GERMINACIÓN DE SEMILLAS DE PALMERAS
José Grassia. Resistencia. 2008.
Si bien algunas especies de palmeras pueden ser multiplicadas por reproducción vegetativa (asexualmente o clonación) ya sea utilizando métodos para dividir las matas, separar estolones, hacer acodos aéreos (margotas) o quitar chupones (brotes), los resultados son magros y erráticos no solo por el riesgo de perder las nuevas plantas, sino de matar las plantas originales (madres). De allí que la propagación por germinación de sus semillas sea el método lógico para multiplicarlas.
Debe tenerse muy en cuenta que la reproducción sexual (por semillas) trae aparejado algunas cuestiones que se detallan a continuación:
En la multiplicación por semillas nacen igual cantidad de plantas machos y hembras. Esto complica las cosas en aquellas especies dioicas (plantas masculinas y femeninas en distintos pies) cultivadas comercialmente por sus frutos ya que, lógicamente, solo los pies femeninos producen frutos y los masculinos deben ser desechados o vendidos a precios reducidos. Ejemplos de lo antedicho son los cultivos de Phoenix dactylifera (palma datilera) y Elaeis guinensis (palma de aceite). La propagación asexual a partir de tejido meristemático de ejemplares femeninos seleccionados cualitativa y cuantitativamente permite obtener, no solo una gran cantidad de nuevas plantas, sino que las mismas conserven el sexo y el linaje de sus antecesoras
Otro cultivo de significativa importancia comercial es el Cocos nucifera del cual se obtiene la copra, pero como la especie es monoica (los dos sexos se encuentran en la misma planta) todos los descendientes son productivos sin que la reproducción sexual afecte a la producción de frutos
Un aspecto de la reproducción sexual es que los descendientes tienen genes de ambos padres y las características deseadas en las producciones comerciales se van perdiendo a pesar de las muchas precauciones que se puedan tomar.
Por último y no por ello menos importante es la hibridación, ya sea intergenérica (entre distintos géneros) o interespecífica (entre distintas especies del mismo género). Algunos géneros (como Phoenix) son extremadamente propicios a la hibridación entre las distintas especies integrantes del genero., a tal punto que hoy día, en el cultivo, es mas difícil hallar ejemplares de linajes puros que híbridos.
También es posible hallar cruces entre distintos géneros (por ej. Butia x Syagrus resultando Butyagrus) que no son especies cultivadas para industrialización sino para ornamentación. En la actualidad se las comercializa tanto para coleccionismo como para paisajismo en localidades frías.
Resta sólo destacar que la manipulación genética busca hibridizar no sólo con la finalidad de obtener características específicas con miras a mejorar la producción, sino para desarrollar plantas con determinadas defensas frente a las plagas que las atacan
Un caso ejemplar de lo dicho es el Cocos nucifera (cocotero) de cuyos frutos se obtiene la copra con destino culinario, cosmético e industrial.
Los cruces entre distintas variedades de la especie han permitido lograr palmas precoces que comienzan a dar frutos a los 4 años y de poca altura, lo cual facilita su cosecha. Asimismo se lograron híbridos con resistencia al Lethal yellowing (amarilleamiento letal) una enfermedad virósica transmitida por un insecto (Myndus crudus) y que produce la muerte del ejemplar infestado en aproximadamente 6 meses
No obstante lo antedicho, las palmas, en general, son una de las pocas plantas ornamentales que sólo pueden propagarse por semillas. También se destacan por su lenta y errática germinación.
Se estima que más del 25% de las 2500 especies de palmeras conocidas, tardan más de tres meses en germinar y tienen menos del 20% de germinación total (Tomlinson, 1990). Las razones de este fenómeno no esta claro ya que poca investigación se ha realizado acerca de la inactividad de las semillas. Sin embargo, los productores de palmeras pueden mejorar mucho los resultados de esta actividad prestando atención a algunas cuestiones básicas. El propósito de estos apuntes es dar a conocer y discutir aspectos de cómo manejar y germinar las semillas de palmeras de la forma más rentable y confiable posible.
La semilla de palmera
Las semillas de las palmas varían tremendamente con respecto al tamaño. Las hay desde no más de 4 mm de diámetro, hasta la mayor de cualquier planta con flor: Lodoicea maldivica, (Coco de Mer) que alcanza los 20 Kg. de peso y 50 cm de diámetro.
Las semillas pueden ser redondas o diversamente alargadas con superficie lisa o intrincadamente esculpida y algunas están cubiertas por una cáscara dura e impermeable al agua como al aire. Asimismo, las fibras de la cubierta de la fruta, frecuentemente permanecen adheridas a la semilla, incluso después de limpiarlas.
La energía de reserva almacenada en la semilla de la palmera pasa por el tejido nutritivo (endosperma), que provee de alimento a la plántula en crecimiento por un periodo de tiempo mas largo que la mayoría de las plantas con inflorescencias. La «leche» y la carnosidad blanca de un coco (copra), son endospermos líquidos y sólidos, respectivamente.
Por su parte, el embrión, o germen, de la semilla es muy pequeño, cilíndrico o con puntas y ocupa por completo la cámara donde se aloja.
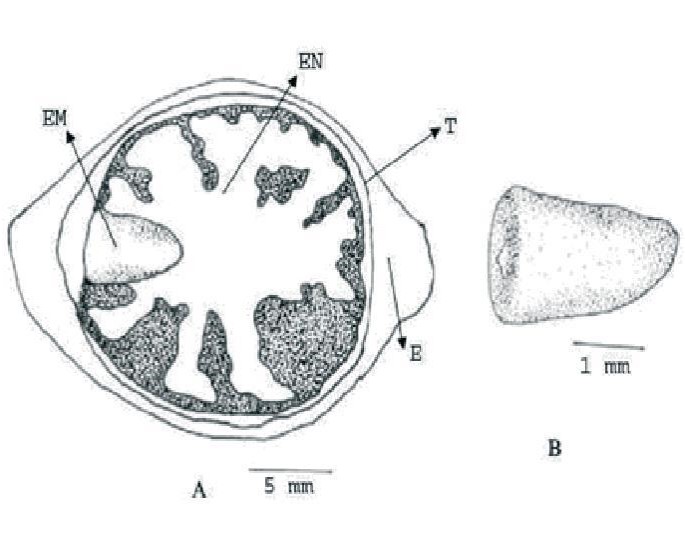
Figura 1 Corte longitudinal de un fruto de Cocos nucifera (Meerow, 1994). A – Partes componentes del fruto: EM Embrión, EN- endosperma, T – tegumento, E – exocarpo B – embrión ampliado
Tipos de germinación de semillas de palmera
La forma de germinar de una semilla de palmera esta dentro de las dos siguientes categorías:
Germinación remota. En este tipo de germinación, el eje de la plántula se desarrolla un poco por debajo de la semilla. La primera estructura que surge del endocarpo se denomina «pecíolo del cotiledón». Se parece, y muchas personas lo confunden, a la primera raíz del plantin. El pecíolo del cotiledón crece descendente en la tierra (a veces muy profundamente) y se dilata en su base. De esta hinchazón, surge la primera raíz del plantin (la radícula) y el retoño del plantin (la plúmula) que al emerger del sustrato formará la primera “aerófila”.
El cotiledón real o restos de la yema, dentro de la semilla, funciona como un órgano absorbente, llamado «haustorio», cuya función es trasferir los nutrientes del endosperma a la plántula.
En las semillas con germinación remota, la radícula persiste durante algún tiempo y produce las raíces laterales. Algunas especies con germinación remota son Phoenix spp. Syagrus romanzoffiana y Bismackia nobilis A su vez esta germinación se divide en dos subcategorías, a saber: remota ligular y remota tubular (Tomlinson 1990)
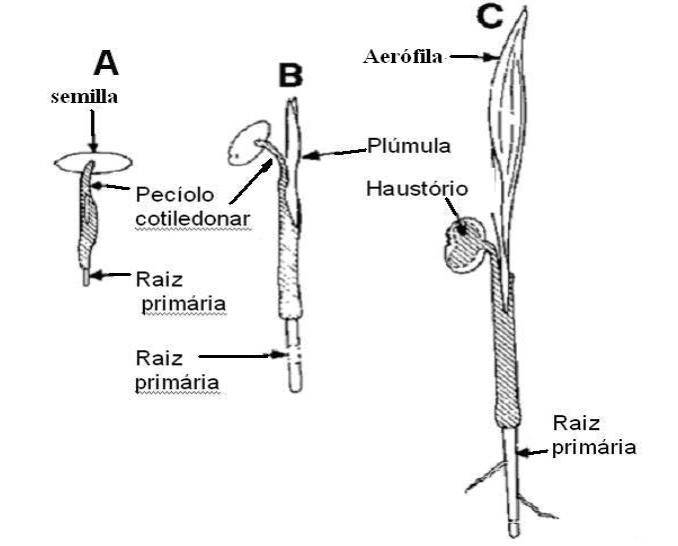
Germinación remota. A- Estadio inicial da germinación, B- Emisión de la plúmula y el peciolo cotiledonar. C- Emisión de la primera hoja (aerófila), raíz primaria alongándose y el haustorio en el interior de la semilla absorbiendo nutrientes del endosperma.
Germinación adyacente. En esta germinación, una pequeña porción del cotiledón surge de la semilla. Aparece como un bulto hinchado que termina en la superficie del endocarpo y se denomina «botón.» La plúmula y la radícula surgen de la cima y el fondo del botón respectivamente.
En las palmas con germinación adyacente, la primera raíz del plantin o radícula es normalmente delgada y perdura poco tiempo siendo reemplazada rápidamente por raíces formadas en la base del tallo del plantin, llamadas “raíces adventicias”. Como en la germinación remota, un haustorio permanece dentro de la semilla absorbiendo el alimento del endosperma.
Algunas especies con germinación adyacente son: Dypsis spp, Archontophoenix spp y Cocos nucifera (cocotero). En el caso particular del coco, la germinación ocurre dentro del mesocarpo y solo puede observarse descascarando la nuez. (coco). Incluso se ha dado casos de comienzos de germinación cuando la fruta aun está en la palma.
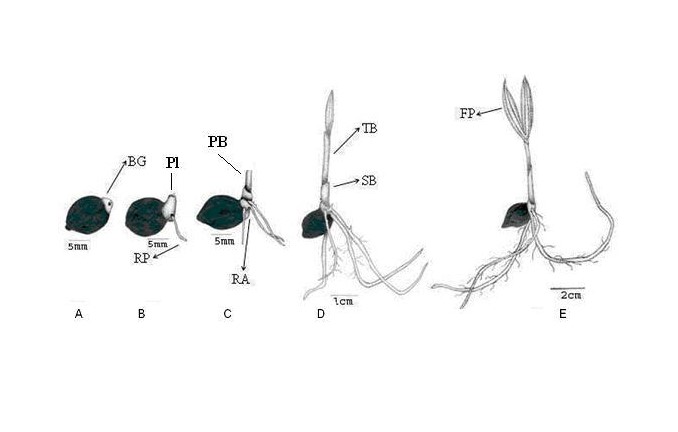
Figura 3. Germinación adyacente de Archontophoenix alexandrae. BG = botón germinativo; RP = raíz primaria; Pl – plúmula; PB = primera vaina; SB = segunda vaina; TB = tercera vaina; RA = raíz adventicia; FP = hoja primaria.
Obtención de semillas
Las semillas pueden recolectarse directamente de plantas locales o ser adquiridas en comercios especializados locales, nacionales o extranjeros, incluso de otros continentes.
La recolección local tiene ciertas ventajas; la frescura, la sanidad, el grado de madurez y linaje de la semilla es normalmente conocido por el comprador.
Si la semilla será almacenada, el productor podrá controlar los métodos usados y la duración de almacenamiento.
Los distribuidores comerciales normalmente pueden ofrecer grandes cantidades y una diversidad mayor de especies, ocupándose también de la limpieza de las semillas que lleva tiempo y a veces, equipos especiales. Sin embargo, cuando se adquiere semillas, muchas veces datos como la edad, maduración y porcentaje de germinación son desconocidos. Probar una muestra de semillas antes de comprar mayor cantidad, es una precaución imprescindible.
Es recomendable cosechar las semillas cuando los frutos están maduros, lo que se deduce por el color que adquieren, el cual varía dependiendo de la especie en cuestión o en cuanto caiga al suelo. Sin embargo, Broschat & Donselman, (1987), mencionan que semillas de frutas verdes de Syagrus romanzoffiana germinan mejor que la semilla medio-madura o madura, quizás debido a los inhibidores de germinación que pueden estar presentes tanto en la cáscara como en la pulpa de la fruta.
Es importante que si se recoge las semillas caídas por acción de la gravedad, se coloque un polietileno al pie de las palmas para poder levantar las semillas con facilidad y rapidez evitando el ataque de insectos del suelo. También es común colocar una bolsa de red envolviendo las infrutescencias en proceso de maduración para recolectar las frutas a medida que se desprenden. Otra alternativa es cortar el racimo de frutos maduros antes de que comiencen a caer
Viabilidad de las semillas de palmeras
La viabilidad de un lote de semillas, no latentes, hace referencia a su capacidad de germinar y de originar plántulas normales en condiciones ambientales favorables.
Dicha viabilidad puede variar entre los individuos de una misma especie, incluso de año a año de la misma palma. La edad de la semilla y/o los métodos de almacenamiento usados puede influir directamente sobre el porcentaje definitivo de germinación. Alguna semillas permanecen viables solo una semanas (Latania spp como ejemplo), mientras que otras pueden ser viables durante un año o más (Acrocomia spp) si se las conserva adecuadamente. (Broschat & Donselman, 1986). Es muy provechoso probar una muestra de la semilla para verificar su viabilidad antes de comprar mayores cantidades.
La forma más simple de comprobar la viabilidad es la prueba de flotación en agua, donde las semillas que flotan son probablemente inviables. No obstante, estas semillas flotantes deben ser sembradas por separado ya que un porcentaje interesante puede germinar
Se debe tener presente, que algunas especies de palmeras tienen semillas que flotan naturalmente ya que en el hábitat se dispersan mediante el agua.
Otros métodos para determinar la viabilidad son los siguientes:
Observación. Corte y abra algunas semillas de la muestra. Los endospermas deben ser firmes y los pequeños embriones deben ocupar totalmente su cámara (ubicada en un extremo de la semilla).
Si el endosperma es blando o esponjoso o el embrión falta o esta arrugado o desteñido o la cubierta de la semilla parece estar deteriorada y/o tiene mal olor entonces la semilla probablemente sea inviable.
Prueba del Cloruro de Tetrazolium (Reactivo de tetrazolio). Corte por la mitad una muestra de las semillas para exponer el embrión y ponga la mitad que contiene el embrión en una solución al 1% (10 gr./l) de Cloruro de Tetrazolium en agua, Coloque el recipiente en la oscuridad durante por lo menos 2 horas (a veces son necesarias 24 horas). Si el embrión se torna parcial o completamente rojo o rosa, es probablemente viable. Si no hay ninguna mancha, la semilla seguramente es inviable.
Limpieza de las semillas
Dentro de los frutos, las semillas están encerradas en una masa carnosa o fibrosa (el mesocarpo) que, con pocas excepciones, debe quitarse antes de almacenarlas para evitar el fermentado y putrefacción. Sin embargo, las semillas frescas pueden ser sembradas sin limpiar, ya que esto es lo que ocurre en la naturaleza, aunque la siembra de algunos frutos enteros demora más en germinar que las semillas limpias. La semilla del coco no requiere descascarado antes de sembrar (de hecho, el plantin desarrolla dentro de la fruta antes de surgir).
Si se limpiara una pequeña cantidad de frutos, la tarea puede ejecutarse a mano, usando un cuchillo para quitar tanto la cáscara como la pulpa de la fruta. Para grandes cantidades, la limpieza con máquina es aconsejable. Las especies que tienen la cáscara de la fruta relativamente delgada, pueden limpiarse fácilmente frotando las semillas en un cedazo de malla fuerte mientras se enjuaga con una manguera para quitar el mesocarpio, o frotándolas entre las manos dentro de un cubo con agua.
Varias especies tienen oxalato de calcio en cáscara y pulpa de la fruta lo cual es urticante en contacto con la piel. En consecuencia deben usarse guantes al manipularlas Algunas de estas especies son las siguientes: todas las Caryota, la mayoría de Chamaedorea, Carpenteria acuminata, Roystonea y Arenga.
La mayoría de las semillas de palmas requieren primero un remojo en agua para ablandar (fermentar) la pared carnosa de la fruta. En lo posible el agua debe cambiarse diariamente. Las frutas están listas para procesar cuando el mesocarpio se desprende fácilmente al tocarlo. Las frutas se colocan en una máquina de limpiar semillas que quita el mesocarpio fermentado de alrededor de la semilla. La pulpa se lava en la cámara de limpieza y sale por debajo. Una pequeña máquina mezcladora de concreto, con arena gruesa o piedras pequeñas, puede ser utilizada para esta tarea. En ambos casos, debe enjuagarse permanentemente las semillas cuando la máquina opera.
Las frutas duras o muy fibrosas pueden ser limpiadas mezclando las frutas con arena gruesa o pedregullo y caminando repetidamente sobre ellas. En algunos casos, semillas extremadamente duras de algunas especies, han sido limpiadas, pasando una camioneta u otro vehículo, por encima de bolsas de arpillera con las frutas dentro con la finalidad de ablandarlas. Una vez limpias, las semillas deben ser secadas al aire y a la sombra antes de almacenarlas.
Almacenamiento de las semillas
Con pocas excepciones, es mejor sembrar las semillas de palmeras poco después de la limpieza y antes de la deshidratación. Si esto no es posible, el procedimiento general para el mejor almacenamiento consiste en: quitar todo el polvo e impurezas a las semillas, secarlas al aire y espolvorearlas con algún fungicida (algunas marcas comerciales pueden ser Thiram, Captan, Benlate) colocar las semillas en bolsas de plástico selladas, y guardar a temperaturas entre 18ºC y 23ºC. Hay alguna evidencia que manteniendo las semillas con fungicida, éste puede influir negativamente en la germinación (Meerow, 1994).
Las semillas de la mayoría de las especies tropicales perderán la viabilidad si se las almacena por debajo de los 15ºC. Broschat y Donselman (1986, 1987, 1988) sostienen que una vez limpias, las semillas de Dypsis lutescens (Areca) podrían guardarse a 22,5ªC durante mas de 1 año sin gran pérdida de viabilidad, las de Roystonea regia durante 9 meses, las de Syagrus romanzoffiana durante 4 meses, y las de Phoenix roebelenii durante 8 meses. En el caso de la R. regia, el almacenamiento por más de 9 meses aumentó la germinación en relación a las semillas frescas sembradas inmediatamente.
Las semillas de Butia odorata (conocida tradicionalmente como Butia capitata) realmente requieren un periodo de almacenamiento seco para una buena germinación (Carpintero, 1988b). La duración del periodo aumenta cuando la temperatura disminuye: 90 días a 25ºC, 120 días a 15°C, y 150 días a 5°C.
Generalmente, las palmas de climas estacionales (versus uniformemente tropicales) pueden tener mayor tolerancia a los almacenamientos a bajas temperaturas.
Tratamientos pre-siembra
Debido a la germinación lenta y desigual de las semillas de palmas, hay mucho interés en cualquier tratamiento anterior a la siembra que pueda acelerar la germinación o produzca mayores o más parejos porcentajes. El productor comercial de palmeras, debe evaluar la rentabilidad contra el costo de cualquier tratamiento anterior a la siembra.
Remojo en agua. El procedimiento más simple y eficaz es remojar las semillas en agua a temperatura entre 20ºC y 25ºC durante 5 a 7 días, cambiando el agua diariamente.
La semilla debe sembrarse inmediatamente después del remojo, ya que el almacenamiento posterior a la rehidratación puede inducir una inactividad (latencia) secundaria.
No todas las especies responden positivamente a un tratamiento de remojo en agua (Broschat & Donselman, 1987, 1988; Carpintero, 1987, 1988; Doughty 1986; Odetola, 1987), y raramente se producen cambios, variando la duración del periodo de remojo, en las semillas de las mismas especies. Sin embargo, al contrario de los otros tratamientos mencionados mas abajo, un remojo en agua no supone un peligro para la semilla.
Remojo en Ácido Giberelico (GA3). Varios investigadores han informado una reducción en el tiempo de germinación, remojando las semillas en una solución de 10 a 2000 ppm de GA3 en agua, durante 1 a 3 días (Doughty, 1986; Nagao & Sakai, 1979; Nagao, 1980; Odetola, 1987).
Sin embargo, el tratamiento con este regulador de crecimiento puede causar el alargamiento excesivo del plantin, y en algunos casos, impedir a la planta sostenerse (Broschat & Donselman, 1987, 1988). Por consiguiente, no es aconsejable usar un tratamiento con GA3 a pesar de cualquier efecto positivo en el porcentaje de germinación ya que los efectos posteriores en las plantas jóvenes son irreparables.
Escarificación. Este tratamiento implica el adelgazamiento del endocarpo óseo de la semilla que suele impedir la absorción de agua. Este adelgazamiento puede lograrse mecánicamente (lijando, limando o rayando) desgastando la superficie de la semilla hasta que el endosperma se haga visible. En algunos casos se aconseja quebrar el endocarpo con un golpe de martillo. (M.L.Robinson 2009)
También se puede escarificar por medios químicos empapando la semilla en ácido sulfúrico diluido al 95% durante 12 minutos (Costas y Santos 2008) o sumergiéndolas en Peroxido de hidrogeno de 30 vol (agua oxigenada) durante 4 días (Infante 1989)
La escarificación ha aumentado el porcentaje de germinación de varias especies de palmas con la cubierta de las semillas duras e impermeables como Acrocomia spp o Jubaea chilensis (Holmquist & Popenoe, 1967; Nagao, 1980; Odetola, 1987).
El peligro en la escarificación mecánica o con ácido es dañar al embrión durante el proceso. La práctica debe reservarse solo para semillas que tienen cubiertas duras e impermeables. Las especies que serán escarificadas, deben ser ensayadas antes de tratar la totalidad del lote.
Siembra de las semillas
Recipientes. El recipiente para realizar la siembra debe responder a los objetivos del productor. Si la idea es repicar las plántulas apenas asomadas las plúmulas y radículas, la germinación puede hacerse en una bolsa o recipientes de pequeño tamaño ya que no influirá para nada en la germinación.
En cambio, si las plántulas permanecerán en el recipiente de germinación hasta lograr un cierto desarrollo radicular, el recipiente deberá tener la profundidad adecuada a la longitud de las raíces según la especie sembrada
Algunos productores, por razones de espacio o comodidad prefieren sembrar en almácigos grandes construidas de madera o ladrillos o camas preparadas directamente en el suelo de tierra. El aspecto mas importante de cualquier recipiente para germinación es el adecuado drenaje del exceso de agua.
Sustrato. El medio de siembra debe ser suelto, con buen drenaje y tener capacidad para conservar la humedad. Las camas de germinación con sustratos resecos o que se encharquen no son aptos para germinar.
El tamaño de las partículas del sustrato no debe ser excesivamente grande para evitar la separación por el riego repetido. Una mezcla de turba y perlita por partes iguales podría considerarse un sustrato universal de siembra.
La mezcla para la germinación depende de las condiciones a que serán expuestas las semillas. Por ejemplo, si las semillas se germinarán a pleno sol, se requerirá un medio con mayor capacidad de retención de agua que las semillas que se germinan a la sombra e igual criterio deben adoptarse para cualquier otra situación.
La profundidad y la densidad de la siembra varían con el tamaño de la semilla y con la especie a sembrar. Sin embargo, las condiciones bajo las cuales se germinará, determinan la profundidad de siembra. Si la germinación se realizara a pleno sol, será necesario cubrir la semilla con sustrato para conservar la humedad.
Una regla práctica consiste en colocar las semillas a una profundidad igual a su diámetro, no obstante, al germinar en la sombra es conveniente sembrar superficialmente.
En el caso de semillas de mayor tamaño es suficiente con apretarlas sobre la superficie del sustrato, dejando la cara superior a la vista. La frecuencia de la irrigación también influirá en la profundidad de siembra.
La densidad de siembra, (cantidad de semillas por unidad de superficie), esta relacionada con el destino de los plantines germinados y de que tan rápido se prevé trasplantarlos. Muchos productores siembran las semillas pequeñas (6 mm de diámetro o menos) y medianas (8 a 25 mm de diámetro), muy densamente en el recipiente de germinación, en algunos casos llegan a cubrir la superficie del sustrato completamente con semillas.
Esta forma de siembra ahorra espacio y trabajo si al trasplantar, se colocaran manojos de plántulas en cada contenedor (por ejemplo, Arecas, Chamaedorea o Euterpe edulis-).
En cambio, es más fácil y eficaz sembrar las semillas levemente separadas un par de cm en el caso de semillas grandes
Para semillas de mayor tamaño aun, es conveniente sembrar directamente en el envase adecuado, tanto en diámetro como especialmente la profundidad, Bismarckia, Borassus y Corypha son buenos ejemplos de lo dicho.
El método de la bolsa. Es común, especialmente entre los aficionados o en las producciones comerciales de bajo volumen, germinar semillas de palmeras siguiendo este método que, por simple y eficaz, resulta muy cómodo.
Se utiliza una bolsa de polietileno con cierre tipo Ziploc (o cualquier otro cierre hermético) de tamaño adecuado a la cantidad de semilla a sembrar. Se coloca dentro de la bolsa una porción de sustrato, que para el caso puede utilizarse musgo Sphagnum, fibra de coco, perlita, vermiculita, algodón o piedra pómez molida, humedecido adecuadamente, conteniendo las semillas a germinar, Se cierra la bolsa y se coloca en sitio cálido. Se controla periódicamente y cuando se observa germinaciones se debe ir repicando las semillas germinadas a envases individuales.
El punto de humedad es muy importante para evitar ataques de hongos. Un sistema práctico para determinar la cantidad de agua consiste en mojar el sustrato y apretarlo con el puño hasta que no caiga ninguna gota de agua
Si bien este método es eficaz y práctico, tiene el inconveniente que por lo general se lo utiliza para germinar a contra estación, es decir que cuando las semillas germinan y se deben repicar a envases individuales, las temperaturas en el exterior de la bolsa son mucho mas bajas y se debe conservar a los plantines con calefacción artificial, lo cual agrega un estrés adicional a la plántula recién nacida. Un detalle de mucha importancia es anotar en la bolsa el nombre de la especie y la fecha de la siembra.
Condiciones de germinación
Todas las palmas requieren temperaturas altas para la germinación más rápida y uniforme de sus semillas. De 20°C a 37°C es un rango aceptable para las aproximadamente 2500 especies, y entre 29ºC y 35°C se obtienen los mejores resultados. Algunas investigaciones sugieren que imitar los cambios de temperaturas diurnos y nocturnos que ocurren en la naturaleza puede aumentar la germinación total en la mayoría de las especies (Carpintero, 1987, 1989), pero esto no es práctico para los cultivos comerciales.
Ya que las semillas de palma requieren temperaturas de germinación altas, lo ideal es sembrarlas durante los meses más calurosos del año. Si la disponibilidad de semilla fresca hace esto difícil, la temperatura del sustrato puede ser aumentada usando calefactores debajo de los recipientes de germinación o cubriendo los recipientes con plástico transparente o calefaccionando con vapor o electricidad el local donde se colocan los recipientes con semillas.
Por regla general no es necesaria la luz solar para la germinación, ya que en la naturaleza, la mayoría de las semillas queda al resguardo del dosel del bosque o de los pastos de las llanuras. Sin embargo algunas especies toleran la exposición solar directa durante la primera etapa de vida, aunque la coloración de las hojas del plantin sea amarillenta (es el caso de las especies xerófitas)
Muchos cultivadores sostienen que, a pesar del amarilleamiento, se refuerza el crecimiento de la raíz y el desarrollo del plantin en general, teniéndolo por completo expuesto al sol. Bajo la sombra, los plantines tendrán generalmente un color verde más profundo y sus órganos alongados. De allí es que, dependiendo de la especie a sembrar, convenga hacerlo bajo malla de media sombra
Durante la germinación, cuando el peciolo del cotiledón (en germinaciones remotas) o el botón (en germinaciones adyacentes) surge de la semilla, es de mucha importancia mantener la humedad constante, Periodos de encharcamiento y sequía en esta etapa, frecuentemente reducen los porcentajes de nacimientos.
Si los recipientes de germinación no están bajo riego automático, es conveniente taparlos con plásticos o vidrios para minimizar la evaporación y así lograr una humedad constante en el sustrato. El exceso de riego puede ser igualmente perjudicial
Tiempo de germinación. El tiempo que tarda en germinar, la uniformidad de la germinación, y el porcentaje de germinación total, puede variar tremendamente de una a otra especie, de la semilla cosechada de distintas plantas de igual especie, e incluso de las semillas cosechadas de la misma planta en distintos años. Las semillas de Washingtonia robusta pueden empezar a germinar en menos de 2 semanas, las de Dypsis lutescens en 3-4 semanas al igual que las de Syagrus romanzoffiana, mientras que las semillas de Chamaedorea elegans no germinan durante varios meses y luego lo hacen esporádicamente durante mas de un año. Por su parte, algunas especies, (como Acrocomia totai), puede requerir más de 18 meses para germinar.
Al sembrar semillas de especies con las cuales no se tiene experiencia anterior, o de las cuales no se cuenta con información, se debe ser paciente mientras las semillas permanezcan en buenas condiciones. Una lista bastante completa de datos de germinación para una amplia variedad de especies de palmeras, puede encontrarse en Wagner (1982).
Trasplante
Pueden trasplantarse las plántulas inmediatamente después de la germinación o después de tener entre 1 y 4 hojas. El objetivo fundamental es reducir, en lo posible, la perturbación de la raíz de los plantines; por este motivo es mejor trasplantar antes de que las raíces comiencen a enroscarse dentro del recipiente, a enredarse con las raíces de plantas aledañas o penetrar demasiado en la tierra para los casos de germinación directa en el suelo.
Lo ideal es trasplantar en los meses calurosos del año, cuando el crecimiento de las raíces es más vigoroso. Retrase el trasplante hasta que la planta tenga al menos una hoja. Los plantines normalmente tendrán una larga raíz al momento del primer trasplante. Deben transferirse las nuevas plantas del recipiente de germinación a una maceta cuyo tamaño permita acomodar el sistema radicular y facilite el próximo crecimiento de la raíz.
Las macetas o bolsas profundas, con grandes aberturas en el fondo, están siendo usadas por la mayoría de los productores, ya que promueven la penetración profunda del sistema radicular y las raíces que asoman son “recortadas” por el aire y cesan en su crecimiento, eliminando significativamente el enroscado de las raíces alrededor de las paredes interiores del recipiente.
Dos estrategias son entonces posibles para el trasplante de los plantines.
La primera indica cambios anuales de macetas (con incremente del 50% del volumen) y la segunda opción es trasplantar directamente a envases grandes según el tamaño que se desea comercializar la palma.
Los cambios de envases frecuentes, disminuyen la posibilidad de pérdidas por exceso de riego, reducen los costos de sustrato utilizado y permite el mejor aprovechamiento de los invernaderos pero aumenta los costos de mano de obra. Trasplantando a recipientes grandes, baja los costos de mano de obra y mantiene el crecimiento de la raíz sin restricción, pero puede promover la pérdida de plantas debido a que la raíz se pudre por exceso de humedad cuando los plantines son pequeños aumentando los costos para el control de la sanidad. Así, los cambios a envases grandes y menos frecuentes, requerirán irrigación cuidadosa y supervisada mientras los plantines se establecen en los nuevos recipientes, como también mayor superficie de invernáculo para igual cantidad de plantas.
Un aspecto que requiere especial atención en cualquier etapa del cultivo, es la profundidad a la cual se plantan las palmeras, sin importar edad o tamaño.
Para los plantines, plantarlos 5 mm más profundo de lo correcto, puede significar severos retrocesos en la producción y/o la muerte de las plantas. Deben enterrarse los plantines hasta el punto del tallo donde se encontraba plantado anteriormente, dónde el sistema de la raíz parece comenzar. Este punto, muchas veces, esta marcado por una hinchazón notable, particularmente en los plantines de mayor edad.
En las palmas de germinación adyacente, el punto es la base del botón.
En los casos de germinación remota no debe cortarse la conexión entre planta y semilla (peciolo cotiledonar) y si la semilla aun esta presente se debe dejar apoyada sobre la superficie del sustrato
Existe la práctica en algunos viveros de recortar las raíces al trasplantar. Esto no es recomendable ya que los resultados son negativos para las palmas y resultan en retrocesos en el crecimiento, incluso en la muerte de algunas plantas
Si la raíz del plantin es más larga que el nuevo recipiente, podría doblarse ligeramente hacia arriba o alrededor del interior del contenedor, aunque la solución ideal es utilizar recipientes con profundidad suficiente para contener adecuadamente al sistema radicular.
Palmeras como Bismarckia y Borassus, entre otras, desarrollan raíces extremadamente largas y deben ser plantadas en forma individual en recipientes especiales que permitan alojar estas raíces. Suelen utilizarse caños de PVC de largo variable (aprox. un metro o mas) para plantar estas especies.
Lo ideal es colocar los plantines recién trasplantados bajo mallas de media sombra (30-50%) durante varias semanas, o hasta que el nuevo crecimiento sea evidente. Si esto no es posible, o en aquellas especies que se hagan crecer a pleno sol, el sistema de riego y la frecuencia de irrigación deben supervisarse cuidadosamente para que los trasplantes no se encuentren demasiados húmedos durante el establecimiento.
Fertilización. Los plantines de palma no requieren fertilización suplementaria durante los primeros dos meses después de la germinación. El endosperma, dentro de la semilla, proporciona toda la nutrición que la nueva planta necesita durante este periodo. La fertilización adicional durante los primeros dos meses no sólo es un gasto innecesario, sino que puede dañar al joven plantin.
Bibliografía consultada
Costas y Santos –ABRATEL vol 18-2008)
Tomlinson, P. B. 1990. The Structural Biology Of Palms. Clarendon Press, Oxford
Carpenter, W. J. 1987. Temperature and imbibition effects on seed germination of Sabal palmetto and Serenoa repens. HortScience 22: 660.
Carpenter, W. J. 1988a. Temperature affects seed germination of four Florida palm species. HortScience 23: 336-337.
Carpenter, W. J. 1988b. Seed after-ripening and temperature influence Butia capitata germination. HortScience 23: 702-703.
Carpenter, W. J. 1989. Influence of temperature on germination of Sabal causiarum seed. Principes 33: 191-194.
Carpenter, W. J. and E. F. Gilman. 1988. Effect of temperature and desiccation on the germination of Thrinax morrisii. Proc. Fla. State Hort. Soc. 101: 288-290.
Broschat, T. K. and H. Donselman. 1986. Factors affecting storage and germination of Chrysalidocarpus lutescens seeds. J. Amer. Soc. Hort. Sci. 111: 872-877.
Broschat, T. K. and H. Donselman. 1987. Effects of fruit maturity, storage, presoaking, and seed cleaning on germination in three species of palms. J. Environ. Hort. 5: 6-9.
Broschat, T. K. and H. Donselman. 1988. Palm seed storage and germination studies. Principes 32: 3-12.
De Leon, N. J. 1958. Viability of palm seeds. Principes 2: 96-98.
Doughty, S. C., E. N. O’Rourke, E. P. Barrios and R. P. Mowers. 1986. Germination induction of pygmy date palm seed. Principes 30: 85-87.
Holmquist, J. de Dios and J. Popenoe. 1967. The effect of scarification on the germination of seed of Acrocomia crispa and Arenga engleri. Principes 11: 23-25.
Kitzke, E. D. 1958. A method for germinating Copernicia palm seeds. Principes 2: 5-8.
Loomis, H. F. 1958. The preparation and germination of palm seeds. Principes 2: 98-102.
Nagao, M. A. and W. S. Sakai. 1979. Effect of growth regulators on seed germination of Archontophoenix alexandrae. HortScience 14: 182-183.
Nagao, M. A., K. Kanegawa and W. S. Sakai. 1980. Accelerating palm seed germination with gibberellic acid, scarification, and bottom heat. HortScience 15: 200-201.
Meerow, A. W. 1994. Fungicide treatment of pygmy date palm seeds affects seedling emergence. HortScience 29: 1201.
Odetola, J. A. 1987. Studies on seed dormancy, viability, and germination in ornamental palms. Principes 31: 24-30.
Wagner, R. I. 1982. Raising ornamental palms. Principes 26: 86-101.
Meerow A.W. and Broschat T.K. Container Production of Palms. IFAS-UFL 1991.Bul 1163
M. L. Robinson Cultivated Palm Seed Germination University of Nevada Coop Extension 2009
Infante, D. 1989. Estudio de la germinación de la Palma chilena (Jubaea chilensis) , Facultad de Ciencias Forestales, Universidad de Chile.